-
Productos
-
Instrumentos de Lab
-
Sondas y medidores de laboratorio
Estándares de calibración Medidores y sondas Sension+
- Productos Químicos, Reactivos y estándares
-
Analizadores en continuo
Analizadores de amonio Analizadores de cloro Analizadores de fosfato
- NP6000sc
- Sistema FX610/FX620
- Sistema Filtrax
- 5500 sc
- 9611 sc
- NP6000sc Chemistry/Reagents
- Phosphax Sigma
- Phosphax sc
- Phosphax sc LR
Analizadores de la serie EZ- Hierro
- Aluminio
- Manganeso
- Fosfato
- Cloruro
- Cianuro
- Fluoruro
- Sulfato
- Sulfuro
- Arsénico
- Cromo
- Cobre
- Níquel
- Zinc
- Amonio
- Nitrógeno total
- Fósforo total
- Fenol
- Ácidos grasos volátiles
- Alcalinidad
- ATP
- Dureza
- Toxicidad
- Acondicionamiento previo de muestras
- Boro
- Color
- Nitrato
- Nitrito
- Sílice
- Peróxido de hidrógeno
- EZ Series Reagents
- EZ Series Accesorios
- Serie EZ sc para compuestos inorgánicos
- Serie EZ sc para metales
- Serie EZ sc para nutrientes
-
Sensores y Controladores en continuo
Controladores digitales (transmisores) Controladores (analógicos) Sensores de Amonio Sensor de monitorización de sulfuro de hidrógenoSensor de pH y ORP
- 1200-S Redox
- 1200-S pH
- 12mm pH/Redox
- 8362 sc Agua ultrapura
- LCP pH/Redox
- Redox Digital diferencial
- pH Diferencial
- pH Digital diferencial
- pH/Redox Combinado
Aceite en agua Elementos orgánicos Acondicionamiento de muestras Ozono Nivel de lodo - Sistemas de laboratorio automatizados
- Multiparameter Online Panels
- Claros Water Intelligence System
-
Material de laboratorio y Suministro
Consumibles generales de laboratorio DispositivosInstrumentosLibros y material de referencia Material de vidrio y de plástico
-
Microbiología
Accesorios y Productos Químicos InstrumentosKits Material de LaboratorioMedios Deshidratados Medios Preparados
- Muestreo
- Test Kits y Tiras
- Electroquímica
-
Instrumentos de Lab
- PARÁMETROS
-
Soluciones de software
-
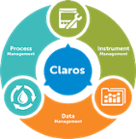
Claros Water Intelligence System
Pilares del producto Process Management
- Soluciones para:
- Eliminación de DBO/DQO
- Nitrificación/desnitrificación
- Eliminación del fósforo
- Gestión de fangos
Data Management- Soluciones para:
- Recopilación
- Consulta y análisis
- Generación de informes
- Exactitud de los datos
Instrument Management- Soluciones para:
- Mantenimiento
- Resolución de problemas
- Acceso remoto
- Comparación de laboratorio y proceso
-
Claros Water Intelligence System
- APLICACIONES
- SERVICIOS
- Noticias y Eventos
España
Elija su país o región:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
- Vietnam
Middle East - Africa
Amoníaco y amonio
¿Qué es el amoníaco?
El amoníaco es un compuesto gaseoso, incoloro, de olor acre y altamente soluble en agua formado por hidrógeno y nitrógeno (un átomo de nitrógeno y tres átomos de hidrógeno, NH 3).
El amoníaco se forma naturalmente como producto de la descomposición microbiológica de materia orgánica nitrogenada (proteína animal y vegetal). También se puede producir para su uso en fertilizantes o en la producción de plásticos, productos farmacéuticos y otros productos químicos.
Es normal encontrar amoníaco en las aguas subterráneas debido a los procesos microbiológicos. Sin embargo, la presencia de nitrógeno amoniacal en las aguas superficiales suele ser un indicio de contaminación doméstica. El exceso de amoníaco puede dañar la vegetación y es altamente tóxico para la vida acuática, especialmente a niveles elevados de pH y temperatura.
Agua de amoníaco
Para diversas aplicaciones, el amoníaco se disuelve en agua para producir "agua de amoníaco". Las soluciones de amoníaco acuoso (agua de amoníaco) a granel son inestables y la concentración de amoníaco puede disminuir durante el transporte o el almacenamiento. Por lo tanto, las soluciones entregadas se facturan en función de la concentración de amoníaco entregada a la instalación o al usuario final.
¿Qué es el amonio?
El amonio es un compuesto que contiene un átomo de nitrógeno y cuatro átomos de hidrógeno (NH 4 +). Mientras que el amoníaco es una molécula neutra no ionizada (base débil), el amonio es un ion que lleva una carga positiva. Además, el amoníaco emite un olor fuerte, pero el amonio no huele en absoluto.
El factor principal que determina la proporción de amoníaco en relación con el amonio en el agua es el pH. La actividad del amoníaco también se ve influenciada por la fuerza iónica y la temperatura de la solución. Es conveniente recordar que el amoníaco molecular puede ser perjudicial para los organismos acuáticos, mientras que el ion de amonio es prácticamente inocuo. En el sector del agua, es importante conocer las concentraciones del nitrógeno enlazado a hidrógeno. Por lo tanto, los términos amoníaco y amonio se utilizan indistintamente, representados como NH 3 -N o NH 4 -N, según corresponda, y normalmente expresados en mg/L o ppm de N.
La ecuación química que rige la relación entre el amoníaco y el amonio es la siguiente:
NH 3 + H 2O <-> NH 4 + + OH -
El equilibrio se desplaza hacia la derecha cuando el pH es bajo y hacia la izquierda cuando es alto. En general, a temperatura ambiente con un pH inferior a 6, la proporción de amoníaco-N en forma de NH 3 es muy baja y casi todo el nitrógeno amoniacal está presente en forma de NH 4 +. A un pH de alrededor de 8, la proporción en forma de NH 3 es del 10% o menos, y a un pH ligeramente superior a 9, la proporción es de alrededor del 50%. Una vez que el pH sea > 11, todos los iones de amonio de la solución se presentarán en la forma molecular del amoníaco. La actividad del amoníaco acuoso también es muy inferior con temperaturas bajas.
¿Por qué monitorizar el amoníaco?
El amoníaco se utiliza como reactivo y como parámetro de medición en varias áreas de tratamiento de aguas y aguas residuales.
- El amoníaco natural se monitoriza en el agua de captación.
- Durante el proceso de desinfección por cloraminación, el amoníaco se combina con cloro para tratar el agua potable y hacer que los residuos de los sistemas de distribución duren más.
- A veces el amoníaco se utiliza para el control del pH, como en la industria farmacéutica.
- El amoníaco se monitoriza ampliamente en los procesos de nitrificación y desnitrificación de aguas residuales.
Aunque suele ser inocuo a bajas concentraciones, las altas concentraciones de amoníaco pueden causar daños y suponer un riesgo para la salud. Por ello, los niveles de amoníaco deben monitorizarse y mantenerse de manera adecuada.
Encuentre en Hach ® el equipo de análisis, los recursos, la formación y el software que necesita para monitorizar y gestionar correctamente los niveles de amoníaco en su aplicación específica.
Productos destacados para la monitorización del amoníaco
Analizadores de amonio NH6000sc
Hemos dedicado años a innovar el mejor analizador de amoníaco de su clase (conocido como Amtax) para que funcione con la facilidad que desea y la precisión que necesita. Presentamos el NH6000sc, que requiere menos mantenimiento y cuenta con una opción de sistema de filtración FX6 ligero e integrado.
Más informaciónHach ofrece muchos de los espectrofotómetros líderes en el mercado del análisis de agua.
Comprar ahoraLos instrumentos portátiles, robustos y fáciles de usar de Hach están diseñados para soportar las condiciones exclusivas del trabajo sobre el terreno.
Comprar ahoraMedidor de iones de amoníaco (NH₃) para laboratorio HQ440D con electrodo de ion selectivo ISENH3181
El multímetro de laboratorio Hach HQ440D es un medidor de laboratorio avanzado que elimina las conjeturas en las mediciones.
Más informaciónElectrodos de ion selectivo Intellical (ISENH)
Los medidores HQ se conectan con electrodos Intellical inteligentes que reconocen automáticamente el parámetro de análisis.
Más informaciónMedidores portátiles de la serie HQ
La serie HQ está destinada a profesionales de la calidad del agua que deseen realizar análisis electroquímicos en entornos de campo y de laboratorio.
Más informaciónAnalizadores de amonio de la serie EZ
Los analizadores en continuo de la serie EZ ofrecen múltiples opciones para monitorizar el contenido de amonio en el agua.
Más informaciónLa sonda digital A-ISE sc selectiva de iones de Hach está diseñada para determinar la concentración de amonio directamente en el medio.
Más informaciónEl sensor combinado digital AN-ISE sc de Hach para amonio y nitrato realiza mediciones directas de forma continua mediante un electrodo de ion selectivo.
Más informaciónSL1000 - Portable Parallel Analyzer (PPA) - Colorímetro portátil con USB
El SL1000 Portable Parallel Analyser (PPA) de Hach realiza los mismos tests con menos de la mitad de pasos manuales.
Más información
¿Qué procesos requieren la monitorización del amoníaco?
Tratamiento de agua potable
El amoníaco gaseoso y sus soluciones concentradas deben manipularse con cuidado y de acuerdo con los requisitos normativos. Esto se debe a que el amoníaco tiene propiedades altamente corrosivas que pueden suponer riesgos graves para la salud, que van desde irritaciones leves en los ojos o la piel hasta quemaduras químicas, dependiendo de la concentración. Además, el amoníaco puede causar problemas estéticos, como un sabor u olor desagradables.
Si no se utiliza el amoníaco durante la desinfección, el hecho de que esté presente en un sistema de distribución es un indicador de la degradación de los materiales utilizados en la construcción de las tuberías o de la contaminación del agua debido a daños en el sistema. Si el amoníaco no deseado se combina con el cloro, la fuerza de desinfección de la cloración disminuye.
Cloraminación
En algunos procesos de desinfección, el amoníaco se combina de manera intencionada con cloro para producir monocloramina. Aunque el cloro libre es un desinfectante más potente, la monocloramina (cloro y amoníaco enlazados) tiene un residual más estable, por lo que permanece más tiempo en el sistema de distribución, lo que garantiza que la desinfección se mantenga hasta llegar al grifo. Además, las cloraminas reaccionan con menor intensidad con diversas impurezas en el agua bruta, en particular con sustancias orgánicas, lo que minimiza la formación de algunos subproductos de desinfección cancerígenos (DBP). Para optimizar el proceso de cloraminación, es importante monitorizar la formación de las especies desinfectantes de interés y evitar la formación de dicloramina o tricloramina (tricloruro de nitrógeno), menos recomendables. El análisis de monocloramina se utiliza junto con la determinación de amoníaco libre para garantizar la formación del desinfectante adecuado y reducir los costes en materias primas al evitar la sobrealimentación de cloro o amoníaco.
Amoníaco libre
El amoníaco que no se ha unido al cloro durante la desinfección por cloraminación se denomina amoníaco libre (tanto NH 4 + como NH 3). Con un pH neutro y a temperatura ambiente, casi todo el amoníaco está presente en forma de NH 4 +. A medida que el pH y la temperatura aumentan, la cantidad de NH 3 se incrementa mientras que la cantidad de NH 4 + disminuye. Cuando se libera agua cloraminada, los niveles de amoníaco libre aumentan a medida que la monocloramina reacciona con diversos compuestos orgánicos y bacterias en el agua del sistema de distribución para satisfacer la demanda de cloro. El aumento de los niveles de amoníaco libre indica el inicio de la nitrificación. Una reducción repentina de amoníaco libre sugiere que la nitrificación está en proceso y que se está formando nitrito. El valor de amoníaco libre es útil para determinar la cantidad de cloro libre necesaria para aumentar el residual de la monocloramina en una estación de bombeo. El nivel de amoníaco libre se puede reducir añadiendo cloro libre en una proporción de 5:1 como Cl2:N para guiar el proceso y ayudar a minimizar la potencial nitrificación.
Amoníaco total
El amoníaco total es la suma de todo el nitrógeno amoniacal presente en forma de monocloramina (NH 2Cl), otras cloraminas, ion de amonio (NH 4 +) y amoníaco molecular (NH 3). Este parámetro puede servir como verificación primaria o secundaria para mantener el proceso de cloraminación bajo control.


Tratamiento de aguas subterráneas y superficiales
El amoníaco se forma como un subproducto cuando las bacterias descomponen los materiales naturales en el suelo. Las altas concentraciones de amoníaco pueden deberse a un suelo rico en hierro, a la proximidad a un bosque o a fertilizante y a la contaminación fecal.

Tratamiento de aguas residuales
Durante el tratamiento de aguas residuales, los niveles de amoníaco pueden alcanzar concentraciones extremadamente altas como resultado de la acción bacteriana. El amoníaco se convierte primero en nitrato a través del proceso de nitrificación para que pueda reducirse a nitrógeno atmosférico (N2) mediante la desnitrificación. Obtenga más información sobre tratamiento de aguas residuales municipales. A altas concentraciones y con un pH elevado, el amoníaco puede ser tóxico para los microorganismos encargados de la digestión de los lodos. Además, para prevenir daños en la vida acuática, es crucial monitorizar y eliminar el amoníaco del efluente de aguas residuales antes de que se libere en masas de agua naturales.

Acuicultura
Como residuo de la vida acuática, el amoníaco puede ser tóxico para los peces y las plantas acuáticas a niveles de tan solo 0,5 mg/L. En los acuarios, el amoníaco se convierte rápidamente en nitrito, y, por último, en nitrato. El objetivo de la mayoría de los acuarios es tener un nivel cero de amoníaco.
En entornos acuáticos naturales, los niveles altos de amoníaco pueden provocar un crecimiento excesivo de algas que bloquearían la luz solar, por lo que los sistemas de alimentación y la fotosíntesis se verían afectados.

Agricultura
Como las plantas no pueden fijar el nitrógeno directamente desde la atmósfera, dependen de las bacterias fijadoras de nitrógeno para convertir el nitrógeno en amoníaco. Las plantas utilizan nitrógeno en forma de amoníaco para crear otras moléculas orgánicas esenciales necesarias para los organismos complejos. Se suele añadir amoníaco a los fertilizantes para respaldar o mejorar este proceso natural (que forma parte del ciclo del nitrógeno). Por ejemplo, las soluciones de nutrientes hidropónicas añaden nitrógeno en forma de sal de amoníaco. Otra manera de añadir amoníaco al suelo es a través de la dosificación de urea y de su descomposición secuencial.

Fabricación de productos farmacéuticos
En la industria farmacéutica, el amoníaco se utiliza para el control del pH y su solución sirve para regenerar las resinas de intercambio iónico débil y para ajustar el pH.
¿Cómo se monitoriza el amoníaco?
Método del salicilato
El método del salicilato es una variación del conocido método de fenato, pero con la ventaja de estar libre de sales de mercurio y fenol. Este método es muy útil para la determinación de nitrógeno amoniacal de rango bajo. Aunque el procedimiento implica varios pasos antes de que se desarrolle el color verde final, todos los reactivos están contenidos en sobres de reactivo en polvo (sobres de reactivo de salicilato en polvo y sobres de cianuro alcalino en polvo) o en cubetas test LCK.
- Los compuestos de amoníaco reaccionan con el cloro para formar monocloramina.
- La monocloramina reacciona con el salicilato y forma 5-aminosalicilato.
- El 5-aminosalicilato se oxida en presencia de un catalizador, el nitroprusiato (también llamado nitroferrocianuro), que da como resultado la formación de indosalicilato, un compuesto de color azul. El color azul está enmascarado por el color amarillo (debido al exceso de nitroprusiato), lo que da como resultado una solución de color verde. La intensidad del color verde resultante es directamente proporcional a la concentración de amoníaco de la muestra.

Electrodo sensible al gas
El electrodo de amoníaco mide el gas amoniacal en las soluciones acuosas o los iones de amonio que se han convertido en gas mediante la adición de una base fuerte. El electrodo es una celda electroquímica completa que consta de un electrodo de pH de vidrio y un electrodo de referencia. La membrana permeable al gas separa la muestra de una fina capa de electrolito que se presiona entre el bulbo de pH y la membrana. A un pH alto, el ion de amonio se convierte en gas amoniacal. El gas se difunde a través de la membrana y provoca un cambio de pH en la fina capa de electrolito. El potencial en el vidrio de pH cambia como resultado del cambio de pH y el electrodo mide el cambio de potencial. El cambio del pH medido es proporcional a la concentración de amoníaco en la solución.
Sobremesa/Portátil:
Electrodo selectivo de iones (ISE) de amoniaco (NH₃) Intellical ISENH3181
En continuo:
Método Nessler
En la prueba de amoníaco, el reactivo Nessler (K 2HgI 4) reacciona con el amoníaco presente en la muestra (en condiciones fuertemente alcalinas) para producir una especie de color amarillo. La intensidad del color es directamente proporcional a la concentración de amoníaco.
2K 2HgI 4 + NH 3 + 3KOH → Hg 2OINH 2 + 7KI + 2H 2O
De sobremesa:
Portátil:
En continuo:
Preguntas frecuentes
¿Qué métodos se pueden utilizar para informar de la presencia de amoníaco en aguas residuales a la EPA?
El nitrógeno amoniacal se puede medir con un espectrofotómetro (o colorímetro) o un electrodo de ion selectivo (ISE) de amoníaco. A continuación se indican los métodos aceptados o equivalentes de la Agencia Estadounidense de Protección Medioambiental (USEPA) para el análisis de aguas residuales.
Método de Nessler de nitrógeno amoniacal 8038 - aceptado por la USEPA para el análisis de aguas residuales (necesita destilación), método 350.2.
Método TNTplus de nitrógeno amoniacal 10205 - equivalente
Métodos 10001 y 10002 de electrodo de ion selectivo (ISE) de nitrógeno amoniacal - estos procedimientos se pueden utilizar con los métodos estandarizados para el análisis de agua y de aguas residuales 4500-NH3 E para la elaboración de informes del NPDES de la USEPA.
¿Por qué los reactivos de salicilato de amonio LCK son equivalentes para la EPA pero los reactivos de salicilato TNT AmVer no lo son?
Las cubetas test LCK de amonio LCK304, LCK303, and LCK305 se consideran equivalentes para el análisis y la elaboración de informes de aguas residuales por la Agencia Estadounidense de Protección Medioambiental (USEPA). Los sets de reactivos de amonio TNT AmVer no se consideran equivalentes para la elaboración de informes de la USEPA.
Hach ha creado un método con el formato de la EPA que incluye datos de soporte paralelos para que los reactivos de salicilato de amonio TNTplus ® sigan el MUR y la equivalencia estatal, algo que no se ha hecho para los reactivos de salicilato TNT AmVer más antiguos. Si un usuario quiere considerar los tests de amonio TNT más antiguos para el cumplimiento de la normativa, puede ponerse en contacto con el organismo normativo correspondiente.
Consulte el método con formato de la EPA, "TNTplus Ammonia-Spectrophotometric Measurement of Ammonia Nitrogen and Total Kjeldahl Nitrogen in Water and Wastewater" para obtener más información sobre la equivalencia de la USEPA con 350.1 y 351.1.
¿Los métodos de salicilato y Nessler detectan amoníaco o amonio?
Tanto el método Nessler como el de salicilato se basan en una reacción con amoníaco molecular en una solución básica. Si la muestra original contuviera iones de amonio, los reactivos básicos los convertirían en amoníaco molecular, que reaccionaría y contribuiría al resultado final de la prueba. Sin embargo, estos sencillos tests de amoníaco no incluyen el amoníaco presente en grupos amino enlazados orgánicamente. Un verdadero test de amoníaco total incluye cloraminas y requiere calentar la muestra en una solución ácida para digerir el amoníaco orgánico.
Dado que el resultado de la prueba es una suma de amoníaco molecular (NH 3) y amonio iónico (NH 4 +), la unidad preferida para la elaboración de informes es el nitrógeno (NH 3 -N). La mayoría de los colorímetros y espectrofotómetros de Hach ofrecen la opción de convertir los resultados de los tests entre nitrógeno, amoníaco y amonio. Esto no cambia la química del test: solo las unidades. Hay que tener en cuenta que, aunque la cantidad de nitrógeno es la misma en el amoníaco y el amonio, la relación estequiométrica de N en NH3 y NH 4 + no es exactamente igual debido a la diferencia en el número de átomos de hidrógeno.
- Para convertir de mg/L NH 3 -N a mg/L NH 3, multiplique por 1,216.
- Se calcula a partir de la masa de NH 3 dividida por la masa de N (17,034 ÷ 14,01 = 1,216).
- Para convertir de mg/L NH 3 -N a mg/L NH 4, multiplique por 1,288.
- Se calcula a partir de la masa de NH 4 +dividida por la masa de N (18,042 ÷ 14,01 = 1,288).
¿Qué mide realmente el analizador Amtax sc?
Cuando la medición se muestra en el Amtax sc, las unidades son "NH 4 -N" o "NH 4", lo que significa que la medición del instrumento se expresa en forma de amonio y los valores se notifican en forma de nitrógeno (también descrito como "NH 4 como N") o como amonio. No hay diferencia entre expresar la concentración de amoníaco ("NH 4 -N" o "NH 3 -N") porque en ambos casos se calcula como nitrógeno, que es la misma cantidad en ambas formas de amoníaco.
El analizador Amtax sc añade hidróxido sódico (NaOH) para ajustar el pH y convertir los iones de amonio (NH 4 -) en amoníaco gaseoso (NH 3), que pasa a través de una membrana selectiva de gas amoniacal y provoca una variación de pH en una solución electrolítica. Este cambio de pH en el electrolito se mide como una señal de mV proporcional a la concentración de amoníaco (NH 3) de la muestra.
¿Qué concentración de amoníaco es tóxica para los peces?
El amoníaco está presente en el agua en forma de ion de amonio (NH 4 +) o amoníaco no ionizado (NH 3). El amoníaco no ionizado es tóxico para los peces, mientras que el ion de amonio solo es tóxico en concentraciones extremadamente altas. Con un pH neutro de 7 y a temperatura ambiente, casi todo el amoníaco está presente en forma de NH 4 +. A medida que el pH y la temperatura aumentan, la cantidad de NH 3 se incrementa mientras que la cantidad de NH 4 + disminuye.
Para medir la concentración de amoníaco no ionizado en una muestra, siga los pasos que se indican a continuación:
- Mida la concentración de amoníaco mediante cualquier método de amoníaco, excepto el método de amoníaco libre.
- Mida el pH y la temperatura de la muestra. Consulte la tabla titulada "Percentage Un-ionised Ammonia in Aqueous Solution by pH Value and Temperature Calculated from data in Emerson, et. al*" en la página 11 del FF2 Freshwater Aquaculture Test Kit Manual..
- Determine el porcentaje de NH 3 utilizando la tabla, el pH de la muestra y la temperatura de la muestra.
- Multiplique la concentración de amoníaco por el porcentaje de la tabla y, a continuación, divida el resultado por 100.