-
Productos
-
Instrumentos de Lab
-
Sondas y medidores de laboratorio
Estándares de calibración Medidores y sondas Sension+
- Productos Químicos, Reactivos y estándares
-
Analizadores en continuo
Analizadores de amonio Analizadores de cloro Analizadores de fosfato
- NP6000sc
- Sistema FX610/FX620
- Sistema Filtrax
- 5500 sc
- 9611 sc
- NP6000sc Chemistry/Reagents
- Phosphax Sigma
- Phosphax sc
- Phosphax sc LR
Analizadores de la serie EZ- Hierro
- Aluminio
- Manganeso
- Fosfato
- Cloruro
- Cianuro
- Fluoruro
- Sulfato
- Sulfuro
- Arsénico
- Cromo
- Cobre
- Níquel
- Zinc
- Amonio
- Nitrógeno total
- Fósforo total
- Fenol
- Ácidos grasos volátiles
- Alcalinidad
- ATP
- Dureza
- Toxicidad
- Acondicionamiento previo de muestras
- Boro
- Color
- Nitrato
- Nitrito
- Sílice
- Peróxido de hidrógeno
- EZ Series Reagents
- EZ Series Accesorios
- Serie EZ sc para compuestos inorgánicos
- Serie EZ sc para metales
- Serie EZ sc para nutrientes
-
Sensores y Controladores en continuo
Controladores digitales (transmisores) Controladores (analógicos) Sensores de Amonio Sensor de monitorización de sulfuro de hidrógenoSensor de pH y ORP
- 1200-S Redox
- 1200-S pH
- 12mm pH/Redox
- 8362 sc Agua ultrapura
- LCP pH/Redox
- Redox Digital diferencial
- pH Diferencial
- pH Digital diferencial
- pH/Redox Combinado
Aceite en agua Elementos orgánicos Acondicionamiento de muestras Ozono Nivel de lodo - Sistemas de laboratorio automatizados
- Multiparameter Online Panels
- Claros Water Intelligence System
-
Material de laboratorio y Suministro
Consumibles generales de laboratorio DispositivosInstrumentosLibros y material de referencia Material de vidrio y de plástico
-
Microbiología
Accesorios y Productos Químicos InstrumentosKits Material de LaboratorioMedios Deshidratados Medios Preparados
- Muestreo
- Test Kits y Tiras
- Electroquímica
-
Instrumentos de Lab
- PARÁMETROS
-
Soluciones de software
-
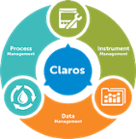
Claros Water Intelligence System
Pilares del producto Process Management
- Soluciones para:
- Eliminación de DBO/DQO
- Nitrificación/desnitrificación
- Eliminación del fósforo
- Gestión de fangos
Data Management- Soluciones para:
- Recopilación
- Consulta y análisis
- Generación de informes
- Exactitud de los datos
Instrument Management- Soluciones para:
- Mantenimiento
- Resolución de problemas
- Acceso remoto
- Comparación de laboratorio y proceso
-
Claros Water Intelligence System
- APLICACIONES
- SERVICIOS
- Noticias y Eventos
España
Elija su país o región:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
- Vietnam
Middle East - Africa
Nitrógeno total
¿Qué es el nitrógeno?
El nitrógeno es un elemento químico con el símbolo N, el número atómico 7 y la masa atómica de 14. Puede mostrarse en forma de molécula diatómica (N 2) como gas incoloro o formar parte de un compuesto líquido o sólido. Alrededor del 78 % de la atmósfera terrestre está compuesta de nitrógeno en estado gaseoso, lo que lo convierte en el elemento no combinado más abundante. A lo largo del ciclo del nitrógeno, este elemento pasa de la atmósfera a la biosfera (en compuestos orgánicos), y luego vuelve a la atmósfera. Los organismos complejos necesitan nitrógeno para construir moléculas esenciales, como aminoácidos (y, por lo tanto, proteínas), ácidos nucleicos (ADN y ARN) y adenosín trifosfato (ATP, molécula transportadora de energía). Como las plantas no pueden utilizar nitrógeno en estado gaseoso, dependen de las bacterias fijadoras de nitrógeno del suelo que convierten el nitrógeno en amoníaco y nitrito. Las bacterias formadoras de nitrato convierten el nitrito en nitrato en condiciones aerobias. El nitrato es el estado en el que el nitrógeno está más oxidado.
Nitrificación y desnitrificación
La nitrificación es el proceso de oxidación biológica de dos pasos para convertir el amoníaco en nitrito, y, por último, en nitrato. La desnitrificación es un proceso microbiano en el que el nitrato se reduce para producir nitrógeno molecular. Los procesos de nitrificación y desnitrificación se utilizan sobre todo en los procesos de tratamiento de aguas residuales. Durante estos procesos, las bacterias autótrofas, como las nitrosomonas, o las heterótrofas, como las nitrobacterias, utilizan las diferentes condiciones de las zonas óxicas (aeróbicas) y anóxicas del tratamiento de aguas residuales para convertir el amoníaco, el nitrito y el nitrato en gas nitrógeno.
El control del oxígeno es fundamental para la nitrificación, además de otros factores importantes, como la alcalinidad. Durante la nitrificación, el oxígeno disuelto (OD) se debe monitorizar y controlar. Para que la desnitrificación sea eficaz, es necesario que no haya oxígeno disuelto y que haya una cantidad adecuada de carbono fácilmente degradable.
Nitrógeno total Kjeldahl
El término nitrógeno total Kjeldahl hace referencia a la combinación de amoníaco y nitrógeno orgánico. Sin embargo, no incluye nitrógeno en forma de nitrito ni nitrógeno en forma de nitrato.
Nitrógeno total
El nitrógeno total es la suma de todas las formas de nitrógeno presentes en el agua, incluidos el amoníaco y el nitrógeno enlazado orgánicamente (nitrógeno total Kjeldahl), el nitrito y el nitrato.
Amoníaco y amonio
El amoníaco y el amonio tienen una relación específica de pH y temperatura.
Tratamiento de aguas
Las propiedades corrosivas del amoníaco (en forma gaseosa y en soluciones concentradas) pueden causar desde irritaciones leves en los ojos o en la piel hasta quemaduras químicas, dependiendo de la concentración. Además, incluso con niveles bajos, el amoníaco puede causar problemas estéticos, como un sabor u olor desagradable.
Tratamiento de aguas residuales
Incluso en concentraciones muy bajas, el amoníaco es tóxico para la vida acuática. Las plantas de aguas residuales vierten agua tratada en una amplia variedad de ubicaciones. La mayoría de las plantas de tratamiento vierten sus aguas en aguas receptoras que tienen usos específicos y vida acuática. La combinación de estos factores determina el nivel de amoníaco que puede emitir una planta de tratamiento de aguas residuales sin causar daños.
¿Por qué se debe medir el nitrógeno?
Mientras que el nitrógeno en forma de amoníaco, nitrito y nitrato es un nutriente esencial para las plantas y los animales, el exceso de nitrógeno puede ser perjudicial en muchos casos.
- Una concentración alta de nitrógeno en masas de agua puede eliminar el OD y, por lo tanto, tener un impacto negativo en la vida acuática.
- El agua potable con un exceso de nitrógeno en forma de amoníaco o nitrato puede suponer un riesgo para la salud pública. Además, los cambios en las concentraciones de nitrito de los sistemas de distribución de agua potable pueden ser un indicador de la aparición de la nitrificación, lo que pone en riesgo la calidad del agua.
- En el tratamiento de aguas residuales, el amoníaco en concentraciones elevadas y con un alto pH puede ser tóxico para los microbios encargados de la digestión de los lodos.
Encuentre en Hach® el equipo de análisis, los recursos, la formación y el software que necesita para monitorizar y gestionar correctamente los niveles de nitrógeno en su aplicación específica.
Productos destacados para medir el nitrógeno
Analizadores de nitrógeno total de la serie EZ
Los analizadores en continuo de la serie EZ ofrecen múltiples opciones para monitorizar el contenido de nitrógeno total del agua.
Comprar ahoraAnalizador de TOC/TN/TP BioTector B7000 de Hach
Un solo analizador para detectar la contaminación por carbono y los niveles de los nutrientes de nitrógeno/fósforo en el agua.
Comprar ahoraHach ofrece reactivos de alta calidad para los análisis de agua rutinarios y más exigentes.
Comprar ahoraEl LT200 está diseñado para ahorrar tiempo y garantizar la exactitud durante los análisis.
Comprar ahora
¿Qué procesos requieren la monitorización del nitrato/nitrito?
Aguas superficiales, aguas mezcladas y aguas subterráneas
El amoníaco, el nitrito y el nitrato pueden formarse de forma natural en masas de agua o estar presentes debido a la escorrentía de fertilizantes y residuos animales, fallos en los sistemas sépticos, la mezcla con agua cloraminada o vertidos industriales con inhibidores de corrosión. Por lo tanto, es importante monitorizar los niveles de amoníaco, nitrito y nitrato para guiar y optimizar el tratamiento.

Tratamiento de agua potable
Si no se utiliza el amoníaco durante la desinfección, el hecho de que esté presente en un sistema de distribución es un indicador de la lixiviación de los materiales utilizados en la construcción de las tuberías o de la contaminación del agua debido a daños en el sistema. Si el amoníaco no deseado se combina con el cloro, la fuerza de desinfección de la cloración disminuye.
Si se utiliza amoníaco para la desinfección durante el proceso de cloraminación, se deben monitorizar y controlar los niveles para no poner en riesgo la salud pública.

Acuicultura
Como residuo de la vida acuática, el amoníaco puede ser tóxico para los peces y las plantas acuáticas a niveles de tan solo 0,5 mg/L. En los acuarios, el amoníaco se convierte rápidamente en nitrito, y, por último, en nitrato. El objetivo de la mayoría de los acuarios es tener un nivel cero de amoníaco.
En entornos acuáticos naturales, los niveles altos de amoníaco pueden provocar un crecimiento excesivo de algas que bloquearían la luz solar, por lo que los sistemas de alimentación y la fotosíntesis se verían afectados.

Agricultura
Las plantas utilizan nitrógeno en forma de amoníaco para crear moléculas orgánicas esenciales necesarias para los organismos complejos. Se suele añadir amoníaco a los fertilizantes para respaldar o mejorar este proceso natural (que forma parte del ciclo del nitrógeno). Por ejemplo, las soluciones de nutrientes hidropónicas añaden nitrógeno en forma de sal de amoníaco. Otra manera de añadir amoníaco al suelo es a través de la dosificación de urea.

Fabricación de productos farmacéuticos
En la producción farmacéutica, la solución de amoníaco se utiliza para regenerar las resinas de intercambio aniónico débil y ajustar el pH del agua de proceso.
Tratamiento de aguas residuales
Los métodos de nitrógeno total miden la carga de nitrógeno en el influente, en las etapas intermedias del tratamiento de fangos y en el efluente para medir la eficiencia general de la planta de tratamiento. La evaluación de los niveles de nitrógeno permite monitorizar el proceso, el ajuste y la eficiencia de la reducción del nitrógeno durante todo el tratamiento.
Los niveles habituales de amoníaco en aguas residuales municipales brutas oscilan entre los 30 mg/L y 50 mg/L de NH 3 -N. Los niveles de nitrato indican la etapa de conversión de las formas de amoníaco y nitrógeno orgánico en nitrato mediante los pasos de tratamiento biológico aeróbico durante la nitrificación.

Edad del fango
Una edad del fango (SRT) y un nivel de sólidos en suspensión en el licor mezcla (MLSS) correctos en el tanque de aireación son fundamentales para cumplir con la normativa en vigor y para realizar un tratamiento eficiente desde el punto de vista energético, lo que garantizará una nitrificación estable.

¿Cómo se monitoriza el nitrógeno total?
Método de reducción con cloruro de titanio (nitrógeno inorgánico total)
Los iones de titanio (III) reducen el nitrato y el nitrito a amoníaco en un entorno básico. Después de la centrifugación para eliminar los sólidos, el amoníaco se combina con cloro para crear monocloramina. La monocloramina reacciona con el salicilato para formar 5-aminosalicilato (una solución verde), como en el método del salicilato en nitrógeno amoniacal (ver nitrógeno y amoníaco).
De sobremesa:
Método de digestión de persulfato (nitrógeno total)
Una digestión de persulfato alcalino convierte todas las formas de nitrógeno en nitrato. Se añade metabisulfito de sodio después de la digestión para eliminar las interferencias de óxido halógeno. En condiciones muy ácidas, el nitrato reacciona con el ácido cromotrópico para convertir en nitrato los anillos de bifenilo de varias ubicaciones y formar varios productos nitrados. Los productos nitrados se miden a 410 nm.
De sobremesa/portátil:
Los compuestos de nitrógeno orgánicos e inorgánicos se digieren con peroxodisulfato y se oxidan a nitrato. Los iones de nitrato reaccionan con 2,6-dimetilfenol en una solución de ácido sulfúrico y fosfórico para formar un nitrofenol. La longitud de onda de medición es de 345 nm.
De sobremesa:
LCK138 - Laton Cubeta test para nitrógeno total, de 1 a 16 mg/L de NTb
LCK238 - Laton Cubeta test para nitrógeno total, de 5 a 40 mg/L de NTb
LCK338 - Laton Cubeta test para nitrógeno total, de 20 a 100 mg/L de NTb
LCK438 - Laton Cubeta test para nitrógeno total, de 100 a 250 mg/L de NTb
Los compuestos de nitrógeno orgánicos e inorgánicos se digieren con peroxidisulfato y se oxidan a nitrato. Al añadir un agente reductor, el nitrato se reduce a nitrito. El nitrito reacciona en un medio ácido con el reactivo de color para producir un complejo azoico violeta. La longitud de onda de medición es de 546 nm.
En continuo:
Analizadores de nitrógeno total de la serie EZ
Proceso de oxidación avanzada de dos etapas mediante el uso de radicales hidroxilos. Análisis fotométrico directo del nitrato después de la oxidación.
Analizador de TOC/TN/TP BioTector B7000 de Hach
Para obtener más información sobre otras formas de monitorizar el nitrógeno, visite estas páginas de parámetros relacionados: amoníaco y amonio, nitrato y nitrito.
Preguntas frecuentes
¿Qué rangos de NT ofrecen los analizadores de la serie EZ?
Los analizadores en continuo de la serie EZ ofrecen múltiples opciones para monitorizar el contenido de nitrógeno total del agua. Las aplicaciones más habituales son las aguas residuales y las aguas superficiales.
- EZ7700: nitrógeno total, 0,1 - 2 mg/L
- EZ7701: nitrógeno total, 0,2 - 5 mg/L
- EZ7702: nitrógeno total, 0,25 - 10 mg/L
- EZ7703: nitrógeno total, 0,5 - 20 mg/L
La serie EZ también ofrece analizadores combinados de TN y TP:
- EZ7600: nitrógeno total, 0,05 - 2 mg/L y fósforo total, 0,01 - 1 mg/L
- EZ7601: nitrógeno total, 0,1 - 5 mg/L y fósforo total, 0,02 - 2 mg/L
- EZ7602: nitrógeno total, 0,2 - 10 mg/L y fósforo total, 0,05 - 5 mg/L
- EZ7603: nitrógeno total, 0,5 - 50 mg/L y fósforo total, 0,05 - 10 mg/L
La serie EZ también puede configurarse para medir TN, NO 3 y NO 2:
EZ7750: nitrógeno total, 0,1 - 2 mg/L; nitrato, 5 - 600 µg/L y nitrito, 10 - 800 µg/L
¿Cuál es la relación entre los compuestos que contienen nitrógeno?
A continuación, se ofrece un resumen de la relación entre los distintos compuestos de nitrógeno y el método recomendado para su análisis:
(NIT) = (NH 3) + (NO 3 -) + (NO 2 -)
(NT) = Nitrógeno orgánico (total) + NH 3 + NO 3 - + NO 2 -
(TKN) = Nitrógeno orgánico (trinegativo oxidante*) + NH 3
*Trinegativo oxidante. No tendrá en cuenta: azida, azina, azo, hidrazono, nitrilo, nitro, nitroso, oxima y semicarbazona
Comparación de los resultados de TKN
TKN = (aprox.) NT - (NO 3 - + NO 2 -)
TKN = (aprox.) NH 3 + Nitrógeno orgánico
Nitrógeno orgánico:
TKN - NH 3 = Nitrógeno orgánico
NT-NIT = Nitrógeno orgánico
Leyenda de siglas y acrónimos:
Nitrógeno inorgánico total (NIT)
Amoníaco (NH 3)
Amonio (NH 4 +)
Nitrato (NO 3 -)
Nitrito (NO 2 -)
Nitrógeno total Kjeldahl (TKN)
Nitrógeno total (NT)
¿Hach cuenta con un test de nitrógeno orgánico total?
Hach no dispone de un método para medir directamente el nitrógeno orgánico total.
Existen dos formas de calcular el nitrógeno orgánico total de una muestra:
- Mida el TKN (nitrógeno total Kjeldahl) y reste los resultados del amoníaco para calcular el nitrógeno orgánico total.
- Mida el nitrógeno total y reste el resultado del nitrógeno inorgánico total para calcular el nitrógeno orgánico total.
undefined